Una muestra de un compuesto de
boro (B) e hidrogeno (H) contiene 6.444 g de B y 1.803 g de H. La masa molar del
compuesto es aproximadamente 30 g. ¿Cuál es su fórmula molecular? (Ejercicio de
Raymond Chang)
Estas cantidades serán los subíndices de la fórmula, que
quedaría así:
Evidentemente, la fórmula empírica
no puede quedar así. Por eso, dividimos cada subíndice entre el menor de ellos,
obteniendo de esta forma, la fórmula empírica:
Para hallar la fórmula molecular, debemos obtener primero la
masa molar de BH3
Como dato del problema, tenemos que la masa molar del
compuesto es aproximadamente 30 g, entonces:
Ahora, multiplicamos la fórmula empírica obtenida por 2, para
obtener la fórmula molecular:
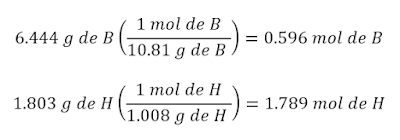
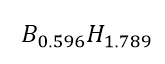
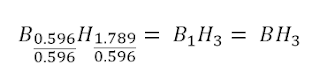
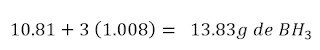

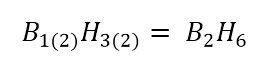



No hay comentarios:
Publicar un comentario