Un método común para la
preparación de oxígeno gaseoso en el laboratorio utiliza la descomposición
térmica del clorato de potasio (KClO3). Suponiendo que la descomposición es
completa, calcule el número de gramos de O2 gaseoso que se obtendrá a partir de
46.0 g de KClO3. (Los productos son KCl y O2)
La química es la ciencia central. Aquí podrás encontrar ejercicios resueltos de química.
Suscribirse a:
Enviar comentarios (Atom)
-
La reacción entre el aluminio y el óxido de hierro (III) puede producir temperaturas cercanas a los 3000 °C, lo que se utiliza para soldar ...
-
Reglas de solubilidad de compuestos iónicos comunes en agua a 25 °C (Tomado de "Química" de Raymond Chang):
-
Cuando se calienta el polvo para hornear (bicarbonato de sodio o hidrógeno carbonato de sodio, NaHCO3) libera dióxido de carbono gaseoso, q...
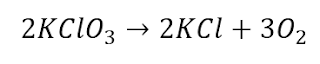




Creo que hay un error ya que en el segundo factor debe ser (3 mol O2/ 2 mol de KClO3), no? Ya que es la proporción dada en el balanceo. Por favor corregirme si estoy mal. GRACIAS.
ResponderEliminarEstas en lo cierto¡¡
Eliminarsi pero al final la respuesta si es correcta aunque se confundió ahí era (3mol O2/2mol KCIO3)
Eliminarhola quisiera saber de donde sale el 122,55gr
ResponderEliminarAquel 122.5 gramos aparece de:
EliminarK+Cl+(O*3)
39,0983 (Masa atómica del Potasio (K)) + 35,453 (Masa atómica del Cloro (Cl)) + (15,999 * 3 (Masa atómica del Oxigeno (O)) )
39,0983 + 35,453 + (15,999 * 3)
39,0983 + 35,453 + 47,997
39,0983 + 83.45
122.5483 gramos/mol de KClO3