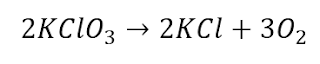En 1934, Edward A. Doisy de la
Universidad de Washintong extrajo 3000 libras de ovarios de cerdo para aislar
unos pocos kilogramos de estradiol puro, una potente hormona femenina. Doisy
quemó 5.00 mg de esta preciosa muestra en oxígeno y encontró que se generaron
14.54 mg de CO2 y 3.97 mg de H2O (ejercicio propuesto de L. G. Wade Jr.)
(a)Determinar la fórmula
empírica del estradiol
Convertimos las cantidades de
productos en masa de carbono e hidrógeno:
El resto debe ser oxígeno:
El número de moles presentes en
5.00 mg de estradiol es:
Ahora, como los subíndices de
las fórmulas químicas deben ser números enteros, dividimos cada una de estas
cantidades entre el menor, quedándonos la fórmula empírica:
(b) Después se determinó que el
peso molecular del estradiol es 272. Determinar la fórmula molecular.
Dividimos el peso molecular real
entre el peso molecular de la fórmula empírica y multiplicamos el resultado por
los subíndices de la fórmula empírica; así, obtenemos la fórmula molecular:
Entonces la fórmula molecular será:
 |
| Estradiol |
 |
| Estradiol |