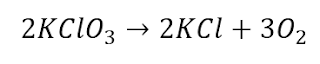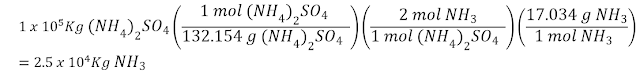Lafeolftaleína es muy útil para determinar la alcalinidad de las sustancias. Cuando está en medio ácido es incolora y cuando está en medio básico es rojo grosella.
PROCEDIMIENTO:
—Pesamos 0.4000 g de fenoltaleína y lo disolvemos en 100 mL de alcohol etílico desnaturalizado.
NOTA: Primero disuelva, con una bagueta, la cantidad pesada en un poco de alcohol etílico desnaturalizado. Una vez disuelta, agregue lo que resta del alcohol.
—Agite para homogenizar.
—Neutralice la mezcla con hidróxido de sodio.
NOTA: Agregue el hidróxido con una pipeta, gota a gota, hasta que la solución se torme mínimamente rosada.
—Guarde y etiquete el frasco (de preferencia de color caramelo) que contendrá al indicador.
Apuntes de Dalton
La química es la ciencia central. Aquí podrás encontrar ejercicios resueltos de química.
miércoles, 3 de octubre de 2018
lunes, 14 de agosto de 2017
¿Qué volumen de una solución de hidróxido de potasio 0.6380 M neutralizará 430.0 mL de ácido sulfúrico 0.4000 M? (problema de Hamilton-Simpson)
¿Qué volumen de una solución de hidróxido de potasio 0.6380 M
neutralizará 430.0 mL de ácido sulfúrico 0.4000 M? (problema de
Hamilton-Simpson)
Este problema es una transformación. Tomamos los datos
iniciales del ácido sulfúrico y los transformamos a volumen de solución de KOH
0.6380M.
La ecuación es la siguiente. Aquí se puede ver que 1 mol de
ácido sulfúrico equivale a 2 mol de KOH.
Procedemos a la transformación:
jueves, 3 de agosto de 2017
Reglas de solubilidad de compuestos iónicos comunes en agua a 25 °C (Raymond Chang)
Reglas de solubilidad de compuestos iónicos comunes en agua a 25 °C (Tomado de "Química" de Raymond Chang):
La disminución de ozono (O3) en la estratosfera
La disminución de ozono (O3) en
la estratosfera ha sido tema de gran preocupación entre los científicos en los
últimos años. Se cree que el ozono puede reaccionar con el óxido nítrico (NO)
que proviene de las emisiones de los aviones de propulsión, a alturas elevadas.
La reacción es:
Si 0.740 g de O3 reaccionan con 6.70 g de NO, ¿cuántos gramos de NO2 se producirán? ¿Cuál compuesto es el reactivo limitante? Calcule el número de moles del reactivo en exceso que se recupera al finalizar la reacción.
Entonces, el RL es el O3, y el RE es NO. Trabajamos con el
RL:
Número de moles de RE recuperados:
martes, 25 de julio de 2017
El óxido nítrico (NO) reacciona...
El óxido nítrico (NO) reacciona
inmediatamente con el oxígeno gaseoso para formar dióxido de nitrógeno (NO2),
un gas café oscuro:
En un experimento se mezclaron
0.886 mol de NO con 0.503 mol de O2. Calcule cuál de los dos reactivos es el
limitante. Calcule también el número de moles de NO2 producido.
El reactivo limitante es el NO.
domingo, 23 de julio de 2017
Un método común para la preparación de oxígeno gaseoso en el laboratorio
Un método común para la
preparación de oxígeno gaseoso en el laboratorio utiliza la descomposición
térmica del clorato de potasio (KClO3). Suponiendo que la descomposición es
completa, calcule el número de gramos de O2 gaseoso que se obtendrá a partir de
46.0 g de KClO3. (Los productos son KCl y O2)
El fertilizante sulfato de amonio [(NH4)2SO4] se prepara...
El fertilizante sulfato de amonio [(NH4)2SO4] se prepara
mediante la reacción entre amoniaco (NH3) y ácido sulfúrico:
¿Cuántos Kg de NH3 se necesitan
para producir 1.00 x (10)5 Kg de (NH4)2SO4?
Suscribirse a:
Comentarios (Atom)
-
La reacción entre el aluminio y el óxido de hierro (III) puede producir temperaturas cercanas a los 3000 °C, lo que se utiliza para soldar ...
-
Reglas de solubilidad de compuestos iónicos comunes en agua a 25 °C (Tomado de "Química" de Raymond Chang):
-
Cuando se calienta el polvo para hornear (bicarbonato de sodio o hidrógeno carbonato de sodio, NaHCO3) libera dióxido de carbono gaseoso, q...