La reacción entre el aluminio y
el óxido de hierro (III) puede producir temperaturas cercanas a los 3000 °C, lo
que se utiliza para soldar metales:
En un proceso se hicieron
reaccionar 124 g de Al con 601 g de Fe2O3 (ejercicio propuesto de Raymond
Chang)
(a)Calcule la masa (en gramos)
de Al2O3 que se formó.
Este es un problema típico de
reactivo limitante. Primero, debemos averiguar cuál de los reactivos es el
limitante:
El reactivo limitante es el Al,
y el reactivo en exceso es el Fe2O3. Por eso, para los cálculos, utilizamos el
Al:
(b)¿Qué cantidad del reactivo en exceso se recuperó al
completarse la reacción?
Nos están preguntando cuánto quedó de Fe2O3.
Los 124 g de Al (2.3 mol) necesitan
2.3 mol de Fe2O3, pero en la reacción tenemos 3.76 mol. Entonces, hacemos una
resta:
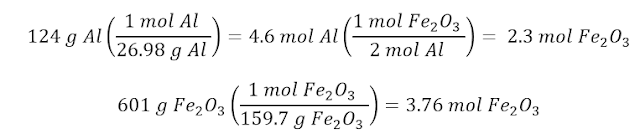

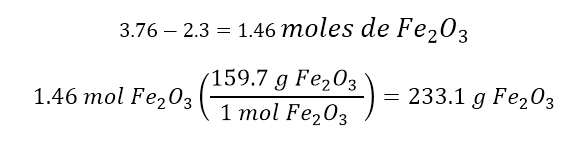



muy bueno
ResponderEliminaryo creo que esta mal el reactivo limitante
ResponderEliminarNeil, esta bien
ResponderEliminarY si el exceso fuera el almuninio??
ResponderEliminarLa nitroglicerina (C3H5N3O9) es un explosivo muy potente. Su descomposición se
ResponderEliminarpuede representar mediante:
4C3H5N3O9 → 6N2+ 12CO2 + 10H2O + O2
Esta reacción genera una gran cantidad de calor y muchos productos gaseosos. La
velocidad de formación de estos gases, así como su rápida expansión, es lo que causa la
explosión.
a) ¿Cuál es la máxima cantidad de O2 en gramos que se obtendrá a partir de 3 00g de
nitroglicerina?
b) Calcule el porcentaje de rendimiento de esta reacción si se encuentra que la cantidad
de O2 producida fue de 6.55 g